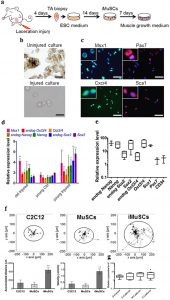
| By applying our established cell isolation method (Fig. 1a) iMuSCs were successfully isolated from the injured murine tibialis anterior (TA) muscle. Three days after the cell isolation, proliferating iMuSCs (~0.1% of the entire muscle cell population) appeared in the culture dishes; however, no cells were present in the cultures that established from the control, uninjured muscles (Fig. 1b). Microscopic evaluation revealed that representative iMuSCs were 5–7 μm in diameter, contained relatively large nuclei and a narrow rim of cytoplasm. Their nuclei were Hoechst 33342 positive and incorporated BrdU (Bromodeoxyuridine) with Msx1 (Msh homeobox 1) expression (Supplementary Fig. S1a). The freshly isolated, or early population of iMuSCs contained a high percentage of Msx1 and Cxcr4 (C-X-C chemokine receptor type 4) positive cells, among which were a few cells expressing Pax7 and Sca1 (Fig. 1c). Gene expression analysis of the entire biopsied injured TA muscles showed that Msx1, Oct4 (also called Pou5f1), Sox2 (SRY-box 2) and Nanog expression were up-regulated compared to the control uninjured old TA muscle (Fig. 1d and Supplementary Fig. S1b). Freshly isolated iMuSCs expressed myogenic stem cell related markers, i.e. Sca1, Pax7 and CD34, and the core pluripotency marker genes, i.e. Oct4, Sox2 and Nanog (Fig. 1e and Supplementary Fig. S1c). Cultured iMuSCs were expanded in vitro in muscle growth medium with an average cell population doubling time of 13 hours. Cytogenetic analysis revealed that iMuSCs had a normal female karyotype; however, chromosomal aberrations appeared during long-term culture (passage 33), resulting in trisomy for chromosome 5 (Supplementary Fig. S1d). We also discovered that iMuSCs had remarkable migration properties. Data from a time-lapse motility assay confirmed that iMuSCs migrated longer distances with higher velocities compared to the control mouse myoblast cell line, C2C12, and MuSCs isolated from control uninjured muscle (Fig. 1f). Moreover, iMuSCs expressed high levels of β-Catenin and several Cadherins at the mRNA level (Fig. 1g). |